Insulin ist ein Hormon, das von deiner Bauchspeicheldrüse in großen Mengen ausgeschüttet wird, sobald dein Blutzuckerspiegel ansteigt.
In Muskeln und Fettgewebe fördert Insulin die Aufnahme von Blutzucker 12. Darüber hinaus gibt Insulin das Signal an die Leber, Leberglykogen aufzubauen und damit weniger Zucker ins Blut abzugeben 3. Auf diese Weise senkt Insulin den Blutzuckerspiegel.
Dieser Artikel ist ein Auszug aus dem Buch der „Ultimative Abnehmen Guide„. Falls du alles zum Abnehmen mit Ernährung, Training und Psychologie wissen möchtest, ist dieses Buch sehr empfehlenswert.
Insulin hat aber parallel auch Effekte auf dein Fettgewebe:
- Insulin blockiert die Abgabe von Fettsäuren aus deinen Fettzellen. Während du hohe Insulinspiegel hast, wird fast kein Fett aus deinen Fettzellen ins Blut abgegeben 4.
- Insulin fördert die Einlagerung von Fett in den Fettzellen. Insulin stimuliert die Aufnahme von Blutzucker in deine Fettzellen 5. Dadurch aktiviert es eine Reihe von Faktoren, die für den Aufbau von einlagerbaren Fetten zuständig sind.
Der Fall scheint nun klar zu sein: Insulin ist das Problem.
Dies wirkt auf den ersten (!) Blick auch völlig logisch. Schließlich kann man mit hohen Insulinspiegeln kein Fett mobilisieren und die Fetteinlagerung wird begünstigt.
Im Umkehrschluss ergibt es Sinn, dass mit niedrigen Insulinspiegeln die Fettverbrennung auf Hochtouren laufen muss und die Einlagerung von Fett erschwert ist.
Die These hält aber bei genauerer Betrachtung nicht stand.
In der Biomedizin ist es häufig verlockend, einzelne Mechanismen herauszugreifen und mit Behauptungen mit einem Fünkchen Wahrheit zu vermischen … um dann in der Interpretation völlig falsch zu liegen. Der Stoffwechsel ist unfassbar komplex und häufig gibt es doppelt und dreifach abgesicherte Stoffwechselwege für den Körper.
Daher ist es oft schlauer, die konkret messbaren Endpunkte (= Fettabnahme) — also das, was man wirklich erreichen möchten — zu betrachten. Sofern diese gewonnenen Einsichten dann nicht zu der mechanistischen Erklärung passen, sollte man vorsichtig werden. Schauen wir uns die Fettabnahme bzgl. Insulin und Abnehmen an:
1. Keine bessere Fettabnahme bei Diäten mit niedrigen Insulinspiegeln
Noakes et al 6 setzen drei Gruppen jeweils für 8 Wochen auf ein Kaloriendefizit von 30 %. Dabei bekam Gruppe A nur 4% ihrer Ernährung aus Kohlenhydraten und Gruppe B schon 50% und Gruppe C stolze 70%. Während sich der Nüchtern-Insulinspiegel bei Gruppe A um 33 % reduzierte, gab es bei Gruppe C sogar eine Erhöhung der Insulinspiegel um 15 %. Nichtsdestotrotz war die Fettabnahme bei allen Gruppen nach 8 Wochen Diät praktisch gleich (Gruppe 1: -4,5 kg, Gruppe 2: — 4,0 kg, Gruppe 3: -4,4 kg). Sofern das Defizit gleich groß ist, haben unterschiedliche Insulinspiegel mit einer variablen Kohlenhydratzufuhr von 4-70% demnach keinen Einfluss auf die Fettabnahme.
In einer weiteren Studie 7 haben stark übergewichtige Frauen mit einer Diät 9,2 kg innerhalb von 60 Tagen abgenommen. Man schaute sich den Zusammenhang der einzelnen Teilnehmerinnen zwischen %Gewichtsverlust und der Gesamtmenge an ausgeschüttetem Insulin an einem Tag von 8-16 Uhr an. Wie in folgender Abbildung zu sehen, konnte man keinen Zusammenhang ausmachen.
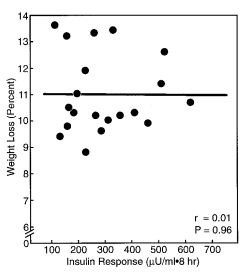
Kein Zusammenhang zwischen %-ualer Gewichtsabnahme und dem Insulinspiegel über 8 Stunden (McLaughlin et al.,1999).
Wären die Insulinspiegel entscheidend für das Abnehmen, müsste man hier einen Trend sehen, der niedrige Insulinspiegel mit einer höheren Gewichtsabnahme in Verbindung setzt.
2. Nehmen insulinresistente Menschen schlechter ab?
Bei Übergewicht tritt häufig eine sogenannte Insulinresistenz auf. Das bedeutet, der Körper muss viel mehr Insulin ausschütten, um dieselben Effekte bei den Zielzellen auszulösen. Insulinresistente Personen haben daher erhöhte Insulin- und Blutzuckerspiegel.
Luis et al. 8 haben über 70 Probanden über 3 Monate lang abnehmen lassen und dabei zwei Gruppen gebildet. Gruppe 1 hatte eine normale Insulinsensitivität, Gruppe 2 war bereits insulinresistent, mit entsprechend erhöhten Insulin- und Blutzuckerwerten. Sofern Insulin nun wirklich die Fettabnahme blockieren sollte, müsste man bei der insulinresistenten Gruppe ja zumindest eine schlechtere Fettabnahme sehen. Doch das war nicht so. Beide Gruppen nahmen genau gleich gut Fett ab und verloren knapp 4 cm an Bauchumfang.
3. Der Glykämisch Index (GI) ist egal
Der glykämische Index (GI) gibt an, wie viel Blutzucker nach dem Verzehr von 50g Kohlenhydraten eines Lebensmittels innerhalb von 2 h danach ins Blut aufgenommen wird 9. Der GI eines Lebensmittels hängt eng mit der Insulinantwort zusammen 10. Je höher der GI, desto größer ist die Insulinausschüttung.
Wenn der Insulin-Effekt einer Diät der entscheidende Faktor für die Gewichtszunahme oder -abnahme wäre, dann würden wir sehen, dass kohlenhydratarme Diäten mit einem niedrigen GI eindeutig Diäten mit einem hohen GI überlegen wären.
Die Mehrheit der Langzeitstudien, die 6 Monate oder länger dauern, zeigen jedoch, dass dies nicht der Fall ist. Der GI macht tatsächlich keinen signifikanten Unterschied beim Gewichts- und/oder Fettverlust1112131415.
4. Insulin ist nicht notwendig, um Fett einzulagern
Übrigens ist Insulin nicht notwendig, um Fett in die Fettzellen zu bekommen. Isst du eine fettreiche Mahlzeit, wird das Hormon ASP (Acylation stimulating protein) für 3–5 h ausgeschüttet und bringt die aufgenommenen Fettsäuren zuverlässig in deine Fettzellen 16.
Wenn du also denkst, dass du deinen Körper austricksen kannst, indem du nur Butter isst oder Olivenöl trinkst, weit gefehlt. Auch wenn sich die Insulinspiegel nach diesen “Mahlzeiten” kaum bewegen werden, werden deine Fettzellen trotzdem gefüllt.
Fazit
Obwohl es sich intuitiv logisch anhört, dass Insulin ein Problem beim Abnehmen sein sollte, zeigen kontrollierte Untersuchungen aus verschiedenen Richtungen, dass dies beim akuten Abnehmen keine entscheidende Rolle spielt.
Eine mögliche Erklärung: Insulin erreicht 2–3 h nach einer durchschnittlichen Mahlzeit wieder sein Ausgangslevel. Das bedeutet: Über 24 h gibt es viele Stunden, in denen der Insulinspiegel niedrig genug ist (Schlaf, Zeiten zwischen dem Essen), um Fett aus den Fettzellen zu mobilisieren.
Zudem sind die Insulinspiegel nach einer 600 kcal Mahlzeit schneller wieder auf ihrem Ausgangsniveau als nach einer 1000 kcal Mahlzeit. Auf diesem Wege könnte die Kalorienzufuhr maßgeblichen Einfluss auf die Dauer des erhöhten Insulinspiegels haben. Direkt nach einer Mahlzeit ist ohnehin nie die Zeit, in der du tatsächlich Fett abnimmst. Die Nährstoffe aus der Ernährung strömen schnell ins Blut und müssen erst einmal in Leber, Muskel- und Fettzellen untergebracht werden. Entscheidend bleibt jedoch nicht, was direkt nach einer Mahlzeit geschieht, sondern, ob nach 24 h mehr Fett aus deinen Fettzellen hinaus- oder in deine Fettzellen hinein strömt.
So logisch es sich auch anhört, man müsse zum Abnehmen nur das Insulin niedrig halten, geht diese Theorie bei genauerer Betrachtung nicht wirklich auf.
